ВВЕДЕНИЕ.
Данная разработка включает лекционный материал по теме “Основные классы неорганических соединений”. На изложение материала отводится один урок, причём данный урок является уроком обобщением изученного материала. В 8 классе, учащиеся уже достаточно подробно ознакомлены с классами неорганических соединений, их свойствами и способами получения соединений. Предлагаемый авторский вариант лекции целесообразно провести в 11 классе, на выходе учащихся из школы, в рамках закрепления уже изученного материала. Тем более что эта тема включена в вопросы экзаменационных билетов, как за курс средней школы, так и экзаменационных билетов ВУЗов, в том числе и ВУЗов химического направления. Учитель последовательно излагает приведённый в разработке материал, используя в качестве наглядного пособия стандартную таблицу “Кислоты” (в которой не только приведены формулы кислот и кислотных остатков, изучаемых в школьном курсе химии, но и даны названия солей, образуемых этими кислотами, валентности кислотных остатков и т.д.). А так как данный урок является уроком повторением изученного материала, то в процессе изложения материала, учитель может периодически вызывать учащихся к доске и просить написать уравнения той или иной реакции, например, получения средней соли, оценивая по ходу урока знания учащихся. Творчески работающий учитель может поэкспериментировать с данным материалом и предложить провести обобщающий урок – повторение заинтересованному учащемуся, а сам выступить в роли наблюдателя. Наверняка в каждом классе найдётся нестандартная личность, увлечённая химией, фанатично преданная своему учителю и возможно мечтающая о поступлении на химический факультет местного педагогического ВУЗа. Этот урок и будет, что называется “картами в руки”, пробой сил учащегося, психологической проверкой на способность к преподаванию столь сложной дисциплины, как химия!
Так в нашей школе уже традиционно в ноябре месяце ежегодно проводится, так называемый, день дублёра. В этот день все уроки ведут учащиеся 11 классов, из их же числа выбирается и администрация школы. Самые разнообразные темы выбирают учащиеся при проведении уроков химии. Эта тема, на мой взгляд, не сложна и не занудна, вполне доступна для изложения хорошо подготовленным учащимся классной аудитории. Попробуйте доверить изложение этого материала учащемуся – дублёру для всего класса, а на следующий день проверьте степень его усвоения. Поделитесь своими наблюдениями с учеником, проводившим урок, поинтересуйтесь его мнением по поводу проведённого урока.
Тип урока: Урок обобщения и систематизации знаний и умений.
Форма урока: Урок – лекция.
Цели урока:
- Повторение, углубление и обобщение сведений об основных классах неорганических соединений (построение названий соединений, классификация, способы их получения).
- Развитие познавательного интереса к химической дисциплине у учащихся.
- Формирование всесторонне развитой, гармоничной личности.
Изучив материал, учащиеся должны будут:
- Знать:
- классификацию неорганических соединений
- построение названий веществ разных классов
- отличительные особенности веществ разных классов
- способы получения веществ разных классов
- Уметь:
строить вещества разных классов по названиям называть вещества разных классов по приведённой формуле составлять уравнения реакций, с помощью которых можно получить то или иное вещество
Фронтальная работа с классом:
- Определение темы урока
- Выявление цели урока
- Регламент работы на уроке*
- Изложение материала в форме лекции учителем или учителем – дублёром (учеником)
*
- в силу достаточно большого объёма, громоздкости материала рекомендуется отводить на изучение материала 50 минут учебного времени, причём начать урок следует не с проверки заданного к уроку домашнего задания (если таковое было задано), а с определения темы (совместно с учащимися) и непосредственного изложения материала в лекционной форме.Наглядный материал:
Рекомендуется заранее на доске или любом видном месте в классе вывесить два плаката – “Схема классификации неорганических соединений” и “Кислоты, кислотные остатки, их названия и валентность”. Эти плакаты стандартные и обычно входят в комплект наглядных готовых пособий (таблиц). При отсутствии таких таблиц их несложно изготовить самому, либо использовать на уроке кодоскоп, с заранее нанесённым материалом на полиэтиленовую плёнку, проектируя таблицу и схему в течение урока на экран
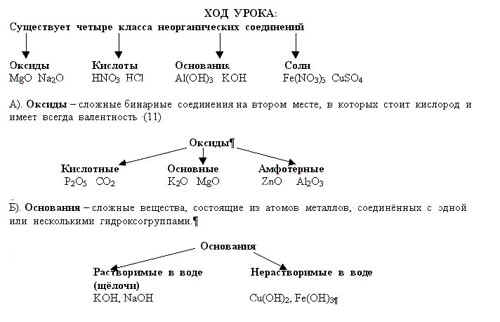
Щёлочи образуют лишь 10 элементов периодической системы химических элементов Д. И. Менделеева: 6 щелочных металлов – литий, натрий, калий, рубидий, цезий, франций и 4 щелочноземельных металла – кальций, стронций, барий, радий.
В). Кислоты – сложные вещества, образованные одним или несколькими атомами водорода, соединёнными с кислотным остатком.
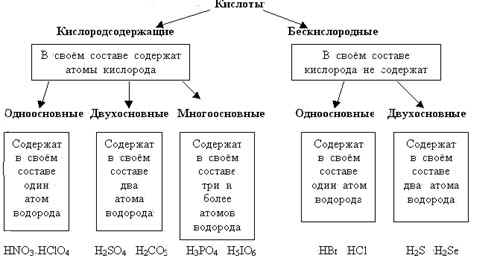
Таблица “Формулы, названия кислот и кислотных остатков”.
Кислота |
Кислотный остаток. |
||
название |
формула |
название |
формула |
Соляная (хлороводородная) |
HCl |
Хлорид |
Cl – |
Плавиковая (фтороводородная) |
HF |
Фторид |
F – |
Бромоводородная |
HBr |
Бромид |
Br – |
Иодоводородная |
HI |
Иодид |
I – |
Хлорноватистая |
HClO |
Гипохлорит |
ClO – |
Хлорноватая |
HClO3 |
Хлорат |
ClO3 – |
Хлорная |
HClO4 |
Перхлорат |
ClO4 – |
Азотистая |
HNO2 |
Нитрит |
NO2 – |
Азотная |
HNO3 |
Нитрат |
NO3 – |
Сероводородная |
H2S |
Сульфид Гидросульфид |
S2 – HS – |
Сернистая |
H2SO3 |
Сульфит Гидросульфит |
SO3 2 – HSO3 – |
Серная |
H2SO4 |
Сульфат Гидросульфат |
SO4 2 – HSO4 – |
Угольная |
H2CO3 |
Карбонат Гидрокарбонат |
СО3 2 – НСО3 – |
Кремниевая |
H2SiO3 |
Силикат |
SiO3 2 – |
Ортофосфорная |
H3PO4 |
Ортофосфат Гидроортофосфат Дигидроортофосфат |
РО4 3 – НРО4 2 – Н2РО4 – |
Муравьиная |
НСООН |
Формиат |
НСОО – |
Уксусная |
СН3СООН |
Ацетат |
СН3СОО – |
Г). Соли – сложные вещества, образованные атомами металлов, соединёнными с кислотными остатками.
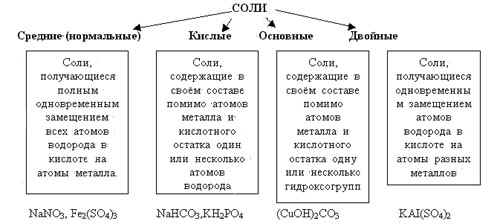
двойной сульфат калия и алюминия
Чтобы правильно назвать кислую соль необходимо к названию нормальной соли прибавить приставку гидро- или дигидро- в зависимости от числа атомов водорода, входящих в состав кислой соли.
Например, KHCO3 – гидрокарбонат калия
КH2PO4 – дигидроортофосфат калия
Нужно помнить, что кислые соли могут образовывать двух и более основные кислоты, как кислородсодержащие, так и бескислородные кислоты.
Чтобы назвать основную соль необходимо к названию нормальной соли прибавить приставку гидроксо- или дигидроксо- в зависимости от числа ОН - групп, входящих в состав соли.
Например, (CuOH)2CO3 - гидроксокарбонат меди (II)
Нужно помнить, что основные соли способны образовывать лишь основания, содержащие в своём составе две и более гидроксогрупп.
Однако, следует понимать, что многие из кислых и основных солей могут существовать лишь только теоретически, реально же в растворах такие соли, как правило, нестабильны.
Основные способы получения солей разных типов:
- Нормальных (средних):
3КОН + Н3РО4 = К3РО4 + 3Н2О
Основание и кислота взяты для взаимодействия в стехиометрических количествах (т.е. реагируют друг с другом без остатка).
Mg + H2SO4 = MgSO4 + H2
CuO + 2HCI = CuCI2 + H2O
Na2CO3 + 2HNO3 = 2NaNO3 + H2O + CO2
Fe + S = FeS
CuSO4 + Zn = Cu v+ ZnSO4
K2O + SO3 = K2SO4
CuOHCI + HCI = CuCI2 + H2O
KHCO3 + KOH = K2CO3 + H2O
2KOH + SO3 = K2SO4 + H2O
CuSO4 + Zn = ZnSO4 + Cuv
Na2CO3 + SO2 = Na2SO3 + CO2^
- Кислых:
2КОН + Н3РО4 = К2НРО4 + 2Н2О
мало много гидрофосфат калияОН + Н3РО4 = КН2РО4 + Н2О
Очень мало оч. много дигидрофосфат калияДля получения кислых солей кислота берётся в избытке, а основание в недостатке.
К2О + Н3РО4 = К2НРО4 + Н2О
Мало Много гидрофосфат калияК2О + 2Н3РО4 = 2КН2РО4 + Н2О
Очень мало Очень много дигидрофосфат калияK2CO3 + H3PO4 = K2HPO4 + H2O + CO2
мало много гидрофосфат калияK2CO3 + 2H3PO4 = 2KH2PO4 + H2O + CO2
Очень мало оч. много дигидрофосфат калияK2HPO4 + H3PO4 = 2KH2PO4
(СuOH)2SO4 + 3H2SO4 = 2Cu(HSO4)2 + 2H2O
дигидроксосульфат меди (11) гидросульфат меди (11)(AI(OH)2)2SO4 + 5H2SO4 = 2AI(HSO4)3 + 4H2O
дигидроксосульфат алюминия гидросульфат алюминияAlOHSO4 + 2H2SO4 = AI(HSO4)3 + H2O
гидроксосульфат алюминия гидросульфат алюминияMg + 2H2SO4 = Mg(HSO4)2 + H2
мало много гидросульфат магния2Ca(H2PO4)2 + (CaOH)3PO4 = 5CaHPO4 + 3H2O
гидроортофосфат кальцияK2O + SO3 + H2O = 2KHSO4
гидросульфат калияFe + 2H2SO4 = Fe(HSO4)2 + H2^
много гидросульфат железа (II)KOH + SO3 = KНSO4
- Основных:
Al(OH)3 + 2HCI = AlOHCI2 + 2H2O
много мало гидроксохлорид алюминияAI(OH)3 + HCI = Al(OH)2CI + 2H2O
очень много очень мало дигидроксохлорид алюминияДля получения основных солей основание берётся в избытке, а кислота в недостатке.
AIOHCI2 + AI(OH)3 = 2AI(OH)2CI
гидроксо хлорид алюминия дигидроксо хлорид алюминияAI(HSO4)3 + 2AI(OH)3 = 3AI(OH)SO4 + 3H2O
гидросульфат алюминия гидроксосульфат алюминияAI(HSO4)3 + 5AI(OH)3 = 3(AI(OH)2)2SO4 + 3H2O
гидросульфат алюминия дигидроксосульфат алюминияAI(HSO4)3 + 2(AI(OH)2)2SO4 = 5AI(OH)SO4 + 4H2O
- Двойных:
КОН + 2NaOH + H3PO4 = KNa2PO4 + 3H2O
двойной фосфат калия и натрияK2O + 2Na2O + 2H3PO4 = 2KNa2PO4 + 3H2O
3Mg + 3Zn + 4H3PO4 = Mg3Zn3(PO4)4 + 6H2
двойной фосфат магния и цинкаK2CO3 + 2Na2CO3 + 2H3PO4 = 2KNa2PO4 + 3H2O + 3CO2
ЛИТЕРАТУРА:
- Рудзитис Г. Е., Фельдман Ф. Г., Химия 11, М., Просвещение, 1989
- Семёнов И. Н., Химия, пособие для поступающих в ВУЗ. Л., ЛГУ, 1986
- Хомченко Г. П., Цитович И. К., Неорганическая химия, М., Высшая Школа, 1978
- Словарь химических терминов под ред. Бусева А. И., М., Просвещение, 1971
- Химия, справочные материалы, под ред. Третьякова Ю. Д., М., Просвещение, 1989